|
Simon MV (2011) Intraoperative Neurophysiologic Sensorimotor Mapping-A
Review. J Neurol Neurophysiol S3.doi: 10.4172/2155-9562.S3-002
Mirela V. Simon, Department of Neurology, Massachusetts General Hospital, Harvard Medical School, 55 Fruit St, Boston
I.
Введение
Главной задачей нейрохирургии супратенториальных поражений остается максимальная резекция с сохранением функционально значимых корковых и подкорковых структур. Многие авторы
[1-9] подчеркивали положительное влияние агрессивного удаления глиом на выживаемость и качество жизни как взрослых пациентов, так и детей. Другие
[10-12] обращали внимание на корреляцию неполной резекции эпилептического фокуса и неудовлетворительного послеоперационного контроля приступов при хирургии эпилепсии.
Тем не менее, во многих случаях достичь максимальной резекции супратенториального поражения очень сложно, если очаг тесно примыкает к функционально значимой коре. Несмотря на значительные достижения в области нейровизуализации, наличие сенситивных микроскопов, просто зрительная инспекция часто недостаточна для разграничения нормальной и пораженной ткани, особенно в случаях нарушенной анатомии и инфильтративных изменений. Более того, аномальная по данным визуального осмотра мозговая ткань может поддерживать нормальное функционирование
[13-15]. Таким образом, функциональное картирование коры является неотъемлемой для безопасной резекции пораженных участков в непосредственной близости к функционально значимым зонам. Под этим обычно подразумевается мультимодальный подход, включающий функциональную МРТ (фМРТ), позитронную эмиссионную томографию (ПЭТ), диффузно-взвешенную МР визуализацию (ДВВ) и нейрофизиологические исследования, при наличии технической возможности – с одновременной корегистрацией различных тестов.
Эта статья представляет собой обзор нейрофизиологических методов картирования сенсомоторной области коры. Возможно одним из наиболее важных преимуществ этих методов по сравнению с нейровизуализацией является «живая» (в режиме реального времени) оценка корковой функции с непосредственной «обратной связью» с хирургом. В отличие от фМРТ нейрофизиологические исследования позволяют также подкорковое картирование
[18] и непрерывный мониторинг сенсомоторных путей во время резекции. Кроме того, на их результаты в меньшей степени влияют перилезиональные гемодинамические изменения. И, наконец, нейрофизиологическое картирование имеет более высокую специфичность по сравнению с другими методами.
Сенсомоторное нейрофизиологическое картирование состоит из двух частей. Первое - это методика реверсии фазы соматосенсорных вызванных потенциалов (ССВП) на стимуляцию контралатерального (краниотомии) срединного нерва с целью локализации центральной борозды (ЦБ). Ее идентификация позволяет хирургу и нейрофизиологу предположить расположение первичной моторной коры. Во второй части (моторное картирование) хирург стимулирует прецентральные отделы для локализации моторной зоны. Прямая электрическая стимуляция выполняется субдурально или эпидурально, с регистрацией ответов в виде мышечных моторных вызванных потенциалов (мМВП) и/или вызванных клинических ответов в контралатеральных стимуляции мышцах пациента. Картирование может выполняться у пациента в сознании или под общей анестезией. Ответы, которые регистрируются при наименьшей интенсивности стимуляции помогают очертить первичную моторную кору. В дополнение к этому, после локализации моторной зоны, продолжение непрерывной стимуляции позволяет мониторировать функцию первичной моторной зоны и кортикоспинального тракта на протяжении всей резекции. Подобным образом регистрация таламокортикальных ССВП помогает идентифицировать соматосенсорную кору и мониторировать проводящие сенсорные пути (толстые волокна) во время резекции. И, наконец, у пациентов в сознании возможна еще более тонкая идентификация участков соматосенсорной коры документацией сенсорных симптомов в ответ на прямую электрическую стимуляцию.
Сокращения:
ЦБ - центральная борозда
ССВП - соматосенсорные вызванные
потенциалы
мМВП - мышечные моторные вызванные
потенциалы
ЭКоГ - электрокортикограмма
ПР - послеразряды
TIVA - тотальная внутривенная анестезия
II.
Локализация центральной борозды
Принцип
В нашем учреждении сенсомоторное картирование начинается с точной идентификации ЦБ. Иногда это удается сделать по анатомическим ориентирам на МРТ
[21]. Однако в некоторых случаях анатомия может изменяться, также наблюдаются нейрофизиологические-нейроанатомические диссоциации при инфальтративной патологии и/или больших перицентральных поражениях. Таким образом, наиболее надежным способом идентификации ЦБ является методика реверсии фазы ССВП срединного нерва
[16, 22, 23].
Известно, что примерно через 19 миллисекунд после электрической стимуляции срединного нерва на запястье контралатеральная соматосенсорная кора (отмечается меткой Cpc, соответствует расположению электродов Cp3 и Cp4 по международной системе 10-20) становится электронегативной – по сравнению с гомологичной зоной противоположного полушария (Cpi – ипсилатерально стимуляции), лобными отделами (Fpz, Fc , F3 или F4) и ипсилатеральным (стимуляции) сосцевидным отростком (Ai). Таким образом, в отведениях Cpc-Cpi, Cpc-Fc или Cpc-Ai таламокортикальные ССВП срединного нерва будут регистрироваться в виде негативного пика с абсолютной латентностью примерно 19 мс (N19). Конечно, эта латентность варьирует в зависимости от особенностей пациента (рост), наличия или отсутствия сенсорных симптомов, типа и глубины анестезии. В любом случае, на той же латенции, что и негативный теменной пик N19, одновременно лобные прецентральные отделы становятся более электропозитивными, чем ипсилатеральный (стимуляции) сосцевидный отросток. В результате в отведении Fc-Ai регистрируется позитивный пик. Поэтому одновременная запись ССВП срединного нерва с контралатеральных прецентральных и постцентральных корковых отделов относительно ипсилатерального сосцевидного отростка (референт) покажет реверсию фазы (на манер диполя) в области ЦБ, идентифицируя таким образом последнюю.
Технические детали
Стимуляция: Наиболее часто стимулируется срединный нерв, хотя возможно регистрировать ответы и с других нервов
[22]. Выполняется биполярная стимуляция в области запястья. Частота повторения стимулов – 3.17 Гц, длительность одного стимула (пульса) 0.3 мс, интенсивность варьирует от 10 до 20 мА (наименьшая интенсивность, которая вызывает устойчивое видимое сокращение большого пальца руки). Поскольку электрическая стимуляция может вызывать неприятные ощущения при краниотомии в сознании, мы всегда информируем пациента, что ему ожидать во время процедуры.
Мы обычно усредняем не менее нескольких сотен ответов. Это важно для достижения хорошего соотношения сигнала к шуму, поскольку при прямой корковой регистрации часто отмечаются пульсация, двигательные и электрические артефакты. Достаточное количество усреднение особенно важно при наличии сенсорных симптомов, когда амплитуда пиков ССВП изначально снижена.
Регистрация: Таламокортикальные ССВП регистрируются посредством субдуральной полоски с 8 электродами, которая располагается хирургом субдурально или эпидурально, перпендикулярно к и пересекая предполагаемую локализацию ЦБ, на полушарии, контралатеральном стороне стимулируемого нерва (Рис.1). Поскольку стимулируется срединный нерв, полоска электродов располагается над предполагаемой зоной проекции руки. В качестве референтного электрода используется субдермальная игла или поверхностный электрод, который располагается над ипсилатеральным (стимуляции) сосцевидным отростком (Ai). Используются как референтный, так и биполярный монтажи. В референтном монтаже реверсия фазы указывает на локализацию ЦБ, тогда как в биполярном монтаже реверсия фазы указывает на наиболее электронегативные и электропозитивные области относительно прилегающих друг к другу электродов – соответственно на постцентральные и прецентральные отделы (Рис.1).
Возможные проблемы
Высокий уровень шума: При интраоперационной прямой корковой регистрации часто возникают артефакты пульсации, сетевой шум (50 Гц). В таких случаях в целом рекомендуется увеличить количество усреднений. Что касается сетевого шума 50 Гц – рекомендуется устанавливать частоту стимуляции, которое не делится без остатка на 2 или 3. Если артефакт пульсации очень выражен, может помочь перестановка электродной полоски несколько в сторону от корковых сосудов. В нашей клинике практически всегда во время картирования возникали те или иные артефакты. Мы прибегаем в таких случаях к ирригации электродной полоски теплым солевым раствором, репозиции или замене электродной полоски, фиксации, в некоторых случаях дефектные контакты просто выключаются.
ССВП не регистрируются: Отсутствие регистрируемых ССВП может быть следствием технических проблем, неадекватной анестезии (см.часть
VII), расположения электродов вдали от соматосенсорной коры, или отсутствия вызванных ответов у симптоматических пациентов. В первую очередь необходимо исключить неправильную (недостаточную) стимуляцию, ошибочные соединения или параметры регистрации. Во-вторых, нейрофизиолог должен убедиться в использовании подходящего режима анестезии. Если технические причины и проблемы с анестезией исключаются, следует предпринять репозицию электродной полоски. Неправильное расположение электродов, вдали от соматосенсорной коры, часто наблюдается в случаях нарушенной анатомии, особенно при смещении перицентральных отделов или нейроанатомических-нейрофизиологических диссоциациях.
Интерпретация
По нашему опыту редко удается получить отчетливую реверсию фазы с первого же расположения электродной полоски. Оставляя в стороне технические проблемы, это является результатом того, что с первой попытки очень сложно получить идеальную позицию полоски – поперек и перпендикулярно ЦБ, а также на правильной «высоте» (область проекции руки) конвекситальной поверхности полушария, особенно при наличии перицентральной патологии. Далее в тексте можно ознакомиться с несколькими «сценариями», которые могут часто возникать на первоначальном этапе внедрения этой методики.
Если на всех каналах в референтном монтаже регистрируется негативный пик, это говорит о том, что полоска целиком располагается постцентрально и не пересекает ЦБ. Следует посоветовать хирургу сдвинуть ее вперед (в передне-задней оси). Подобным образом, если на всех каналах регистрируются только позитивные пики, скорее всего электродные контакты располагаются кпереди от ЦБ, и полоску следует сдвинуть «кзади».
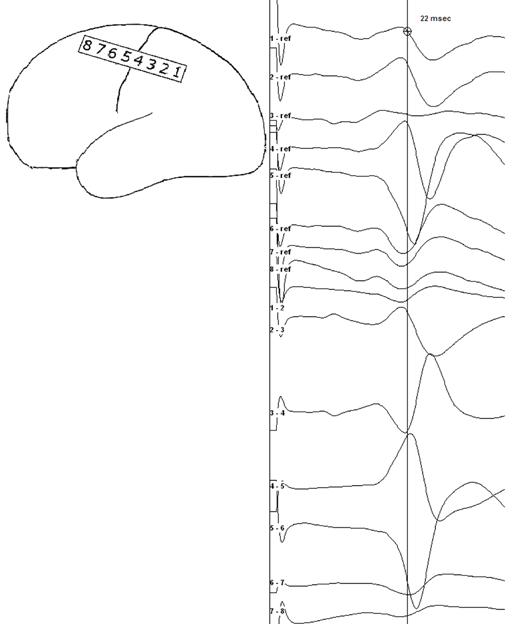
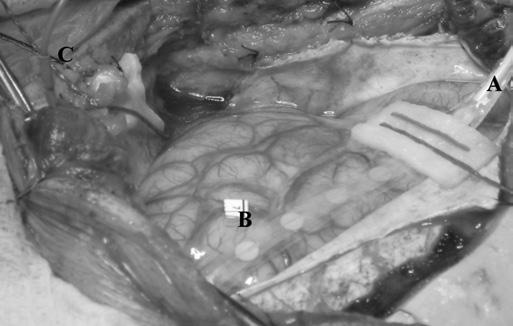
Рис.1 Регистрация субдуральной полоской электродов. А –реверсия фазы ССВП правого срединного нерва. Референциальный и биполярный монтажи, контакт 1 является крайним задним (в передне-задней оси). Референциальный монтаж показывает реверсию фазы на уровне ЦБ: контакт 4 располагается постцентрально и контакт 5 прецентрально. В биполярном монтаже обратите внимание на реверсию фазы под контактом 4, что указывает на наиболее электронегативную зону теменной соматосенсорной коры. B – субдуральная 8-контактная электродная полоска располагается прямо на поверхности коры. Метка А указывает на удлинительный кабель с наиболее близким к нему 8-м контактом, метка В указывает на «флаг» на корковой поверхности, маркирующий функционально значимую зону коры, метка С указывает на на стерильный субдермальный игольчатый электрод, который располагается на краю хирургического поля и соединен с катодом.
Если изменение полярности незначительное или изменена морфология пиков, полоску следует «повернуть», расположив под другим углом. Пример такой репозиции можно найти на
Рис.2.
III.
Локализация первичной моторной коры
Принцип
Для моторного картирования могут применяться как методика реверсии фазы ССВП, так и прямая корковая электрическая стимуляция
[24]. Мы настоятельно рекомендуем использование обоих методов – начиная с локализации ЦБ, как объяснялось в
части II. Это позволит получить хорошую «стартовую точку» для электрической стимуляции и повысит ее точность и в целом эффективность картирования.
Как только ЦБ идентифицирована, можно приступать к прямой электрической стимуляции прецентральных отделов с регистрацией моторных ответов. Эта методика базируется на ранних данных авторов
[25], которые смогли зарегистрировать электрические потенциалы (т.н. D-волны) в кортикоспинальном тракте на уровне пирамид и медуллы. Эти нейрогенные ответы могут регистрироваться также на спинальном уровне. Стимуляция моторной коры также вызывает сокращения дистальных мышц, которые регистрируются электрофизиологически в виде мышечных моторных вызванных потенциалов (мМВП), а также клинически наблюдаются в виде подергиваний, дистоний, тонических или клонических движений контралатерально стимуляции. В нашей клинике мы предпочитаем регистрировать мМВП с соответствующих мышц, не полагаясь на простое визуальное наблюдение, поскольку порог стимуляции для мМВП ниже порога, при котором отмечаются видимые сокращения мышц. Таким образом снижается риск развития судорожных приступов, спровоцированных электрической стимуляцией. Электрофизиологическая регистрация также позволяет одновременно контролировать ответы с большого количества мышц на разных участках тела. В качестве альтернативного метода можно регистрировать D-волны. Их главным преимуществом является более высокая устойчивость к анестетикам и специфичность. Однако регистрация D-волн является инвазивной процедурой, записывающий электрод вводится чрескожно под флюороскопическим контролем в эпилуральное спинальное пространство.
Во время электрической корковой стимуляции необходима непрерывная запись
электрокортикограммы (ЭкоГ) для детекции возможных послеразрядов (ПР), вызванных стимуляцией, Они могут нести риск для пациента (провокация приступов), а также приводить к фальщ-позитивным результатам картирования.
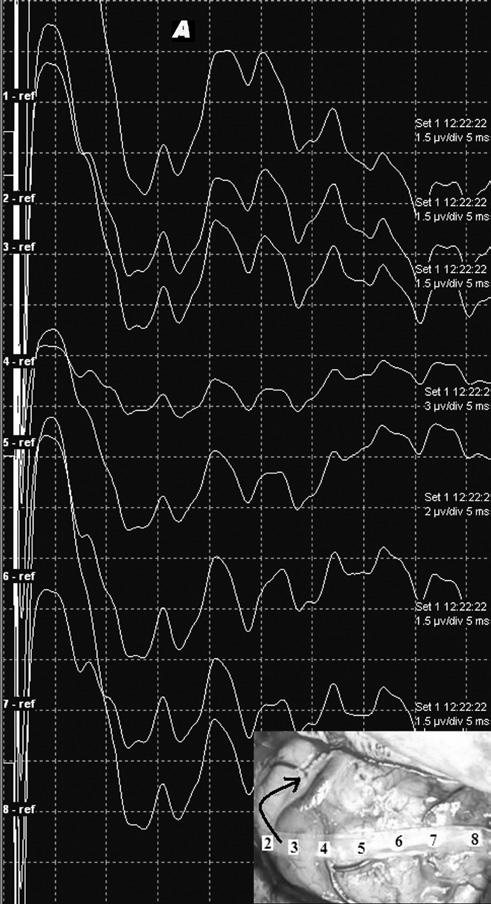 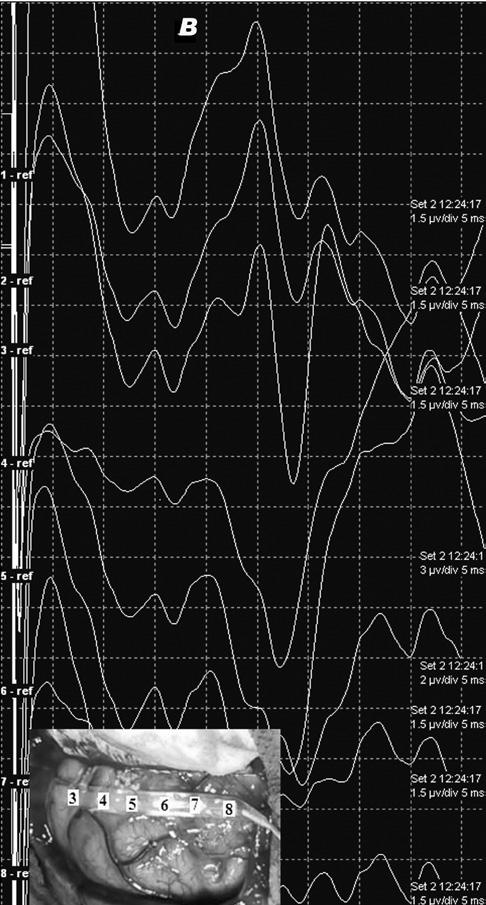
Рис.2 Репозиция регистрирующей субдуральной полоски электродов с улучшением морфологии и амплитуды корковых ССВП, а также реверсии фазы. Панель А – показывает запись электродной полоской в первом положении. Контакт 1 располагается максимально кзади. Нет отчетливо регистрируемых ВП. Панель В – запись ССВП после реориентации электродной полоски, как показано стрелкой на панели А. Отмечается четкая реверсия фазы между контактами 3 (постцентрально) и 4 (прецентрально). Борозда между контактами 3 и 4, таким образом, идентифицирована как ЦБ.
Технические детали
Стимуляция: Хирург выполняет стимуляцию, используя ручной стимулятор – монополярный или биполярный. Мы обычно проводим монополярную стимуляцию, при которой сам стимулятор присоединен к анодному выходу, а стерильная игла располагается по краю хирургического поля, выступая в качестве катода. Эта техника основана на данных ряда авторов
[25, 26], которые показали преимущества корковой анодной стимуляции. Мы применяем мультипульсовую методику (пачка стимулов)
[28]. Она заключается в подаче повторяющихся пачек пульсов, частотой 1-2 Гц, каждая пачка состоит из 4-6 пульсов (межпульсовая частота 250 Гц), длительность каждого пульса 0.5 мс. Одним из преимуществ этой техники по сравнению часто используемой модифицированной техникой Пенфилда, впервые описанной Berger
[3] с соавторами (повторяющиеся биполярные пульсы длительностью 0.5-1 мс, частотой 50-60 Гц) является то, что она позволяет прямую электрофизиологическую регистрацию триггируемых мМВП. При этом следует также учитывать более низкий порог монополярной анодной стимуляции, что повышает эффективность и безопасность процедуры картирования
[29]. Артефакт стимула при мультипульсовой стимуляции значительно менее выражен, облегчая регистрацию и раннюю идентификацию возможных ПР на ЭкоГ.
Во всех точках мы начинаем стимуляцию с интенсивности 1 мА, постепенно увеличивая стимуляции с шагом 0.5 мА, до достижения максимума в 25 мА. Процедура учитывает индивидуальные характеристики пациента
[23]. Первичная моторная кора идентифицируется как область коры, стимуляция которой вызывает устойчивые, воспроизводимые мМВП в контралатеральных мышцах при наименьшей интенсивности стимула по сравнению с другими точками стимуляции (см.
рис.3). Все корковые отделы, стимуляция которых вызывала мМВП, маркировались хирургом (рис.1b).
После идентификации моторной зоны мультипульсовая стимуляция может продолжаться и во время резекции – для непрерывного функционального мониторинга как первичной моторной коры, так и кортикоспинального тракта (дальнейшее описание в
части IV).
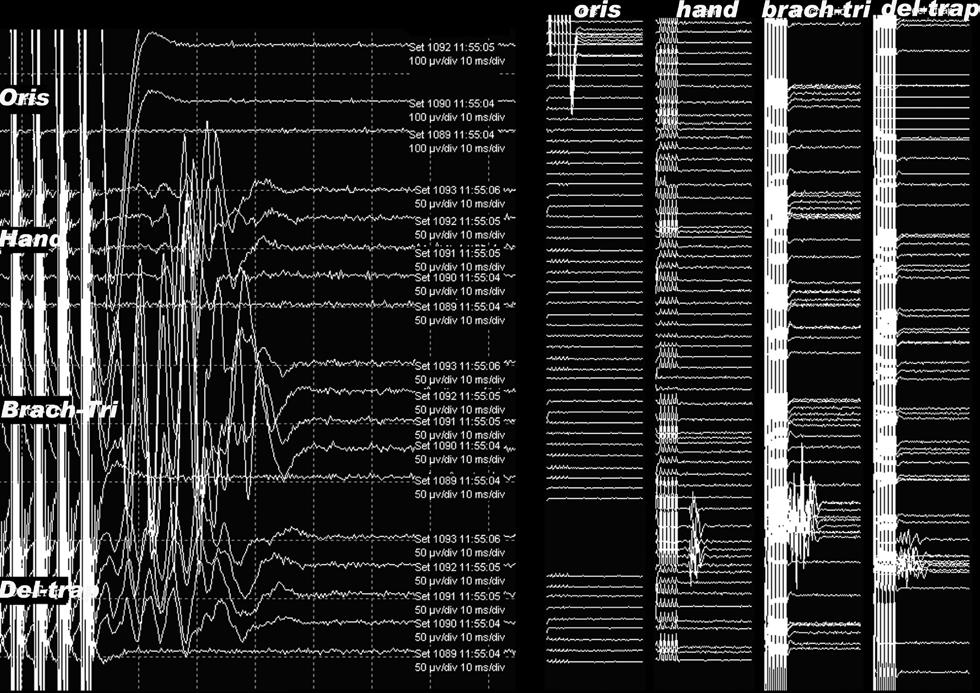
Рис.3. мМВП в ответ на корковую электрическую стимуляцию. Левая панель демонстрирует несколько мышечных каналов, на каждом из которых показаны несколько последовательных ответов, с последними ответами наверху. На правой панели – те же ответы, показанные по другому: отельные колонки для каждой мышцы с последними ответами внизу.
Регистрация моторных ответов: Как отмечалось ранее, мы используем электрофизиологическую регистрацию триггируемых контралатерально стороне стимуляции (краниотомии) моторных ответов (мМВП). Регистрация осуществляется подкожными игольчатыми электродами, которые располагаются на m/orbiclaris oris, orbicularis oculi, masseter, trapezius, deltoid, triceps, brachioradialis, abductor policis brevis (APB), abductor digiti minimi (ADM), quadriceps (Quad), anterior tibialis (AT) и abductor halluces (AH). Один канал может регистрировать ответы с одной или сразу с двух мышц. Последний способ может применяться при ограниченном количестве каналов усилителя, охватывая при этом значительную часть мышц тела. Тем не менее, альтернативный способ (1 мышца на канал) повышает специфичность в плане точной локализации, соотнесения стимулируемой точки коры (моторного гомункулуса) и мыщцы. Это особенно важно при наложения эпидурального коркового стимулятора. Кроме того, 2 регистрирующих электрода,
располагающиеся на близком расстоянии друг от друга над одной мышцей, снижают уровень шумов записи - в отличие от электродов с большим межэлектродным расстоянием.
Подкожные игольчатые электроды можно заменить на поверхностные, например, при краниотомии с пробуждением. В последнем случае можно возразить, что, поскольку пациент находится в сознании, нет необходимости в нейрофизиологической регистрации, поскольку пациент сам может отмечать те или иные симптомы при стимуляции. Однако триггируемые мМВП возникают при меньшей интенсивности стимуляции, чем симптомы или движения. Мы, таким образом, согласны с точкой зрения других авторов
[30], что электрофизиологическая регистрация должна осуществляться независимо от состояния сознания пациента (анестезия или пробуждение). Помимо собственно мМВП, электроды могут регистрировать также двигательную активность при возникновении эпилептического приступа. Эту мышечную активность достаточно легко отличить от мМВП, особенно полезна в данном случае одновременная регистрация ЭкоГ, позволяя вовремя обнаружить эпилептическую активность (рис.4).
Возможные проблемы
Отсутствие регистрируемых ответов (мМВП) может являться следствием различных причин. Во-первых, следует исключить любые возможные технические проблемы. Отсутствие артефакта стимула может сигнализировать о неправильной стимуляции. Следует проверить как соединения и контакты системы, так и программные установки регистрации и стимуляции. При использовании ручного биполярного стимулятора убедиться, что окончания электродов не касаются друг друга. При монополярной стимуляции игольчатый электрод должен находиться в области хирургического поля и подсоединен к катоду. Наконец, нередко причиной отсутствия стимуляции является сам дефективный ручной стимулятор, который следует заменить.
По нашему опыту иногда возникают сложности при регистрации мМВП лицевой мускулатуры при интенсивности на уровне пороговых значений. Обычно в таких случаях мы можем видеть значительный артефакт стимула на каналах регистрации, артефакт перекрывает и «маскирует» коротколатентные и низкоамплитудные лицевые мМВП. Может понадобиться увеличение интенсивности выше порога – чтобы увеличить амплитуду ответов. С другой стороны, можно попробовать уменьшить артефакт стимула (например, заменить заземляющий электрод, изменить фильтры низкой частоты). Похожая ситуация может встретиться при наличии повышенного мышечного «щума», что снижает соотношение сигнал-шум; здесь также может помочь усиление интенсивности стимуляции для увеличения амплитуды регистрируемых мышечных ответов. Мы рекомендуем контролировать импеданс электродов, не превышая значений в 5 кОм.
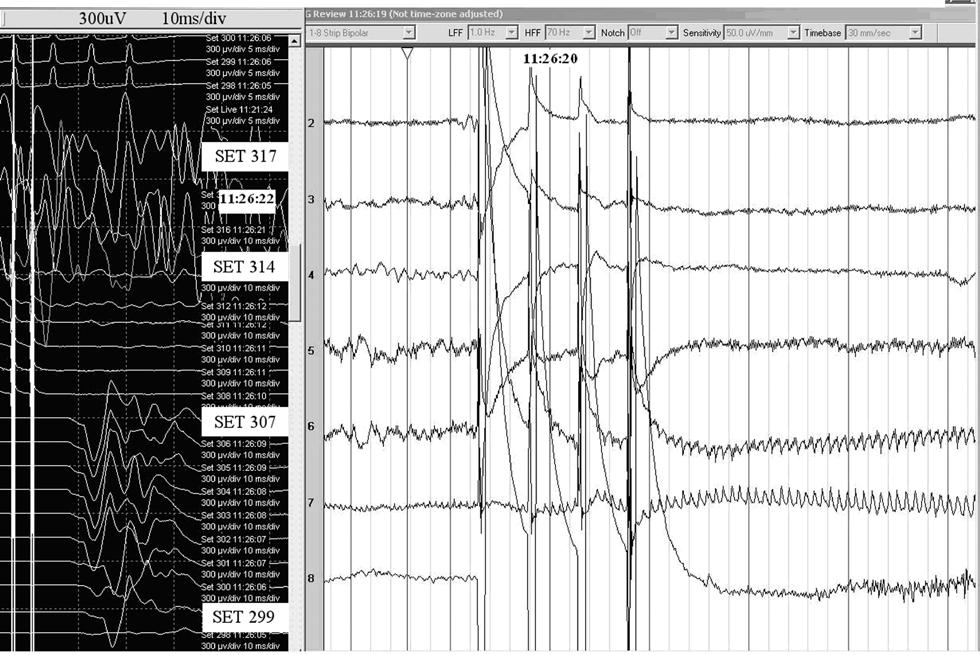
Рис.4 Начало электроклинического приступа, спровоцированного прямой корковой стимуляцией. Иктальные клонические движения контралатеральной руки вызывают значительный мышечный артефакт, который виден на отведениях руки (стимулы 314-317). На предыдущих стимулах (299-307) регистрировались отчетливые мМВП при той интенсивности стимулции. Запись ЭКог отображает электрическое иктальное начало под контактами 7 и 6 электродной полоски в виде ритмическоих пробегов острой активности 12 Гц. Чувствительность мышечной регистрации 300 мкв на деление; эпоха анализа 10 мсек на дел.; регистрация ЭКоГ с чувствительностью 50 мкв/мм, скорость 30 мм/сек.
Интерпретация
Мы учитываем моторные ответы амплитудой не менее 50 мкв (пик-пик), воспроизводимые при последовательной стимуляции одних и тех же корковых отделов. В целом, наличие полифазной морфологии говорит об устойчивой активации; однако у симптоматических пациентов могут регистрироваться мМВП более простой морфологии, с увеличенной абсолютной латентностью, с повышением пороговых значений интенсивности стимуляции.
Для корректной идентификации первичной моторной коры мы настойчиво рекомендуем находить пороговое значение интенсивности стимула, и всю процедуру картирования проводить с использованием пороговых значений. Это важно для разграничения первичной и дополнительной моторной коры – известно, что поражение первой приводит к постоянному послеоперационному моторному дефициту, тогда как повреждение дополнительной и премоторной зон может вызвать преходящий временный дефицит (синдром ДМЗ). Если использовать высокую интенсивность стимуляции, то распространение тока в области, удаленные от точки приложения электрода, может триггировать вызванные ответы «на удалении» и соответственно приводить к неверной идентификации первичной моторной зоны (фальш-позитивные результаты) или ее отдельных участков (Рис.5).
Другой сложной задачей является дифференциация триггируемых мМВП от спонтанной мышечной активности, которая иногда может совпадать по латентности с вызванным ответом. Тем не менее, ее случайное распределение по времени при повторяющейся стимуляции одних и тех же корковых отделов, или вариабельность латентности, помогает дифференцировать от истинных вызванных мышечных ответов.
И, наконец, мышечная активность в регистрирующих каналах может отражать спровоцированный стимуляцией клинический моторный приступ, нередко – на том же пороговом значении стимуляции, что и для мМВП. Однако, как уже отмечалось ранее, морфология этого вида мышечной активности носит другой характер, а наличие синхронной записи ЭКоГ может оказать существенную помощь в идентификации приступной этиологии мышечной активности (Рис.4).
IV.
Непрерывный мониторинг моторных путей во время резекции.
После идентификации моторной «полоски» можно продолжить мониторинг кортикоспинального тракта и первичной моторной коры на протяжении всей резекции, непрерывно стимулируя моторную кору с регистрацией ответов в контралатеральных мышцах (Рис.6). Для этой цели вторая субдуральная электродная полоска располагается прямо над моторной корой, а стимуляция выполняется либо через прилегающие два электродных контакта (биполярная стимуляция), либо через один из электродных контактов субдуральной полоски в качестве анода и стерильной иглой в другой области хирургического поля в качестве катода (монополярная стимуляция)
[31]. Параметры стимуляции и регистрации такие же, как и при картировании моторной зоны. Стимуляция выполняется на пороговых значениях интенсивности. Внезапное снижение амплитуды регистрируемых мМВП должно немедленно привести к остановке резекции, ирригации теплым солевым раствором, попытке изменения тактики резекции. Применяя такой способ мониторинга, мы проводили успешные максимальные резекции прецентральных поражений, избегая при этом послеоперационного неврологического дефицита.

Рис.5 Стимуляция первичной моторной коры выше порога вызывает распространение тока, снижение специфичности стимуляции. Панель А – триггируемые мМВП на канале m. orbicularis oris в ответ на стимулы 154-162 (нижний круг) и второй раз в ответ на стимулы 170-175 (верхний круг). При этом на панелях В и С видны высокоамплитудные мМВП, регистрируемые в m.brachioradialis-triceps и каналах руки – в ответ на стимулы 15-162, когда стимуляция осуществлялась на уровне выше порога картирования. Таким образом, активность, которая регистрировалась на m.orbicularis oris на стимулы 154-162, скорее всего, являлась результатом «растекания» тока от стимуляции первичной моторной зоны руки. Однако, как только амплитуду стимула уменьшили на 4 мА, ответы регистрировались только в m.orbicularis oris (170-175). Обратите внимание, что лицевые мМВП на стимулы 170-175 имеют более высокую амплитуду, более комплексную морфологию с укороченной латентностью, чем в ответ на стимулы 154-162, подтверждая этим предположение, что стимулы 170-175 вызывали прямую стимуляцию лицевой проекционной зоны. Панель D – отображает в сжатом виде хронологию всей процедуры картирования, при этом каждая колонка соответствует отдельному мышечному каналу.
V.
Картирование и мониторинг сенсорной функции и мониторинг
Картирование первичной соматосенсорной области постцентральных отделов обычно выполняется при пробуждении пациента, когда возможна коммуникация, и пациент отмечает отсутствие или наличие сенсорных симптомов при электрической стимуляции.
Тем не менее, как при анестезии, так и при пробуждении пациента, соматосенсорная кора может достаточно надежно идентифицироваться регистрацией ССВП на стимуляцию различных периферических нервов
[32]. Метод уже был описан в части
II. Последующая непрерывная стимуляция этих нервов с непрерывной регистрацией ССВП позволяет осуществлять мониторинг сохранности соматосенсорной коры во время резекции. Внезапное изменение амплитуды, морфологии и/или латентности пиков ССВП может сигнализировать о возможной дисфункции таламокортикальных сенсорных путей.
VI.
Мониторинг ПР
Как указывалось выше, во время корковой электрической стимуляции одновременная регистрация ЭКоГ позволяет также осуществлять непрерывный мониторинг на предмет обнаружения ПР
(Рис.4). С этой целью такая же 8-контактная электродная полоска, которая используется для детекции реверсии фазы ССВП, располагается в тесной близости от стимулируемых корковых отделов, а входы подаются на ЭЭГ каналы усилителя. Проводится непрерывная регистрация в референциальных и биполярных отведениях (референтный электрод располагается на контралатеральном сосцевидном отростке). Параметры регистрации такие же, как и при обычной записи ЭЭГ (может понадобиться снижение чувствительности, поскольку амплитуда ЭКоГ выше амплитуды колебаний скальповой ЭЭГ).
Конечно, запись ЭКоГ позволяет не только идентифицировать ПР, но также уточнять глубину анестезии, в качестве основного ориентира используется паттерн вспышка-подавление. Если вспышки электрической активности мозга отделяются длительными периодами изоэлектрической ЭЭГ, можно ожидать более высоких моторных порогов стимуляции
[22, 23]. Таким образом, возникает возможность более оперативно реагировать и быстро повышать интенсивность стимуляции в необходимых ситуациях.
В дополнение к этому, запись электрокортикограммы позволяет оценивать исходную степень аномальной корковой возбудимости, особенно при эпилепсии, а также у пациентов с опухолью, вызывавшую эпилептические приступы в дооперационном периоде. Это очень важная информация, поскольку электрическая стимуляция изначально гипервозбудимой коры может триггировать ПР и эпилептические приступы гораздо легче. В таких случаях можно думать о дополнительном внутривенном введении антиэпилептических препаратов (АЭП), таких, как фосфенитоин или леветирацетам (кеппра).
Эффективным способом прекращения вызванных стимуляцией ПР является орошение коры ледяным солевым раствором
[33], поэтому еще до начала стимуляции стоит уточнить его наличие.
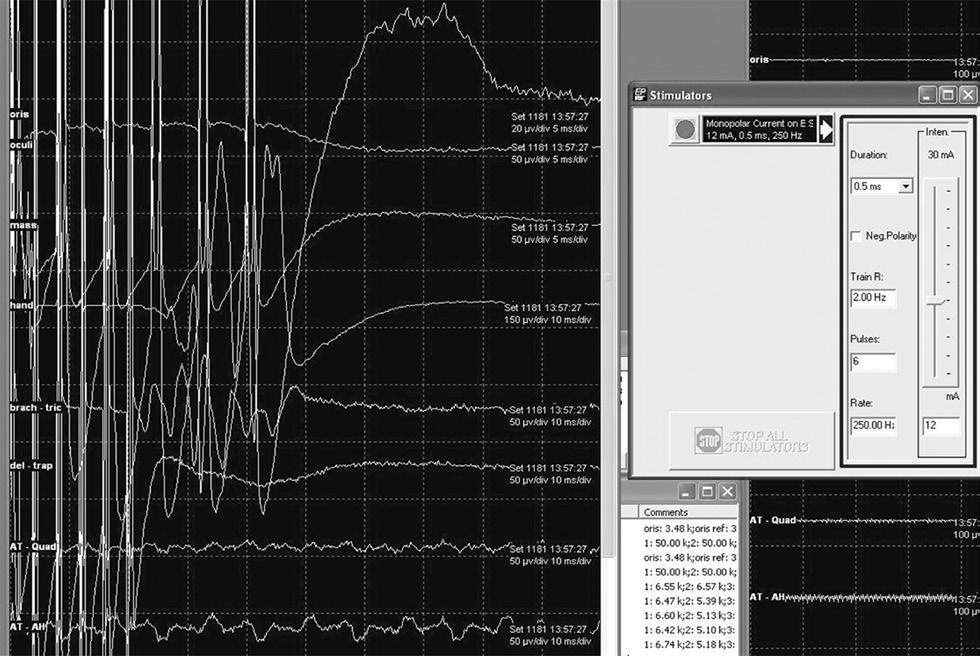
Рис.6 Непрерывный мониторинг мМВП во время резекции в области прецентральной извилины. Стимуляция осуществляется через один из контактов электродной полоски (анод) и стерильную иглу, расположенную на краю хирургического поля (катод). Обращает на себя внимание полифазность мМВП в каналах руки и brachioradialis-triceps. Стимуляция осуществляется повторяющимися (2 Гц) пачками (6 пульсов), длительность одного пульса 0.5 мсек, частота пульсов в пачке 250 Гц.
VII.
Режим анестезии
Хорошо известно, что ингаляционные анестетики, такие, как закись азота и галогены, оказывают существенное негативное влияние на генерацию ССВП, особенно при их совместном применении
[22, 34]. Таким образом, во время операций с применением методики реверсии фазы ВП их использование должно максимально ограничиваться. Если у асимптомных пациентов еще допустимы низкие концентрации ингаляционных анестетиков, у пациентов с сенсорными симптомами, а также у пациентов с плохим исходным (фоновым) профилем ССВП, их использование следует исключить. Применение ингаляционных анестетиков может значительно нарушить морфологию таламокортикальных ответов и затруднить детекцию реверсии фазы (Рис.7). Их влияние может быть еще более существенным, вплоть до полного исчезновения измеряемых волн ССВП.
Подобным образом, ингаляционные анестетики и галогены неблагоприятно воздействуют также на мМВП при прямой корковой стимуляции. Механизмы влияния различны – от снижения корковой возбудимости, задержки аксонального проведения по кортикоспинальному тракту, до снижения синаптической передачи на уровне спинальных альфа-мотонейронов
[35-41].
В целом, во время выполнения методики реверсии фазы ССВП и прямой корковой стимуляции для сенсомоторного картирования, использование ингаляционных анестетиков должно быть максимально ограниченным, заменяться тотальной внутривенной анестезией (ТВВА или TIVA, например пропофолом и ремифентанилом). И, наконец, во время TIVA желательно избегать глубокого уровня анестезии, соответствующего выраженному паттерну вспышка-подавление в ЭЭГ
[42], что может привести к необоснованно высокому моторному порогу
[22, 23, 34].
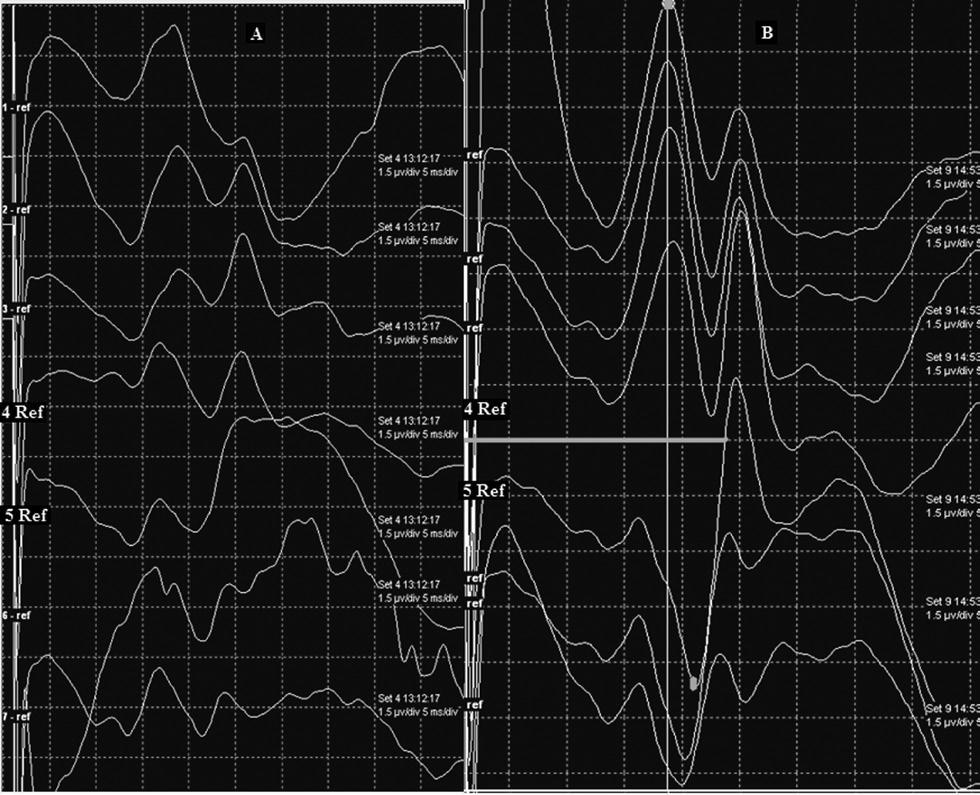
Рис.7 Методика реверсии фазы ССВП на стимуляцию срединного нерва: изменения, вызванные анестетиками. Панель А – корковые ССВП, регистрируемые 8-контактной электродной полоской, во время анестезии закисью азота и севофлураном; идентификация потенциалов N19|P22 и реверсия фазы затруднены. Панель В – запись после изменения режима анестезии на TIVA. Обратите внимание на четкую реверсию фазы ССВП (отмечено вертикальным курсором) на уровне центральной борозды, при этом контакт 4 располагается постцентрально, а контакт 5 в прецентральном отделе.
Перевод статьи при поддержке
"Оксфорд
Медикал"
|